Ở Việt Nam, bệnh rối loạn hô hấp và sinh sản ở heo ( PRRS – Porcine Reproductive and Respiratory Syndrome) hay còn gọi là bệnh Tai Xanh đã được phát hiện vào năm 1997 trên đàn heo nhập từ Mỹ (10/51 con có huyết thanh dương tính). Đến năm 2007 theo thống kê của cục thú y bệnh xuất hiện ở cả 3 miền bắc, trung, nam và đến thời điểm hiện nay bệnh xuất hiện hầu hết tất cả các tỉnh của nước ta…
I. Đặc tính của bệnh
Là bệnh truyền nhiễm cấp tính do virus gây ra, có khả năng lây lan nhanh và chết cao.
Heo mắc bệnh dễ nhiễm trùng kế phát các loại bệnh khác như: Tụ huyết trùng, Streptococcus suis (bệnh liên cầu khuẩn heo), Dịch tả heo, Phó thương hàn, Cúm heo…
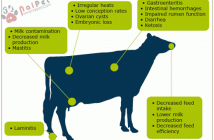
Gây ra hội chứng rối loạn sinh sản và hô hấp như: heo nái sẩy thai ở giai đoạn cuối, chết lưu thai; heo con chết non sau khi sinh, heo sau cai sữa và heo thịt bị viêm phổi.
II. Truyền nhiễm học
a) Lứa tuổi mắc bệnh:
Tất cả mọi lứa tuổi trên heo.
b) Chất chứa căn bệnh:
Dịch mũi, nước bọt, tinh dịch, phân, nước tiểu.
c) Đường truyền lây:
Tiếp xúc giữa heo ốm và heo khỏe là đường truyền lây chính của bệnh nên bệnh có thể lây giữa các cá thể trong một đàn hay từ đàn này sang đàn khác (do heo bị bệnh được chuyển đàn, chuyển trại hoặc lây qua các dụng cụ chăn nuôi).
Tinh dịch heo mang trùng cũng có khả năng nhiễm virus vì vậy bệnh có thể truyền qua đường sinh dục.
Các chât bài tiết như phân, nước tiểu heo bệnh cũng có khả năng chứa virus.
d) Cơ chế sinh bệnh
Yếu tố mở đường => virus xâm nhập vào cơ thể => nhân lên trong cơ thể => phá hủy các đại thực bào (các tế bào có tác dụng bắt và tiêu diệt các tác nhân gây bệnh) => suy yếu sức đề kháng của cơ thể => gây bệnh.
III. Triệu chứng:
Trên heo nái:
- Giai đoạn nái hậu bị và nái khô: chậm lên giống, tỉ lệ đậu thai thấp.
- Giai đoạn mang thai: thai khô, chết thai, sẩy tahi. Có thể lên đến 50% toàn đàn có hiện tượng thai khô, chết thai hoặc sẩy thai. Sau khi sẩy thai, nái bị suy nhược, gầy ốm.
- Một số nái có biểu hiện khó thở, sốt, kém ăn rồi sẩy thai, vùng tai tím.
- Đẻ chậm 2-4 ngày, lượng sữa giảm đáng kể.
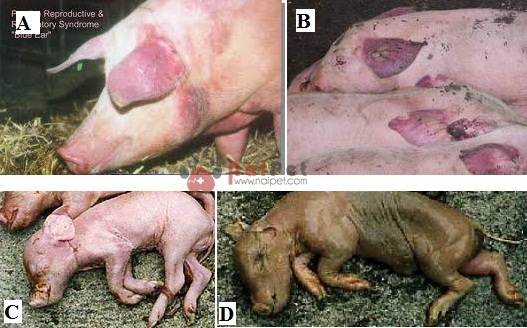
 Tím bầm ở vành tai heo nái
Tím bầm ở vành tai heo nái
 Heo nái gầy yếu không lên giống
Heo nái gầy yếu không lên giống
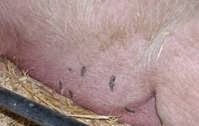 Vùng da bụng heo nái xuất hiện các mảng đỏ
Vùng da bụng heo nái xuất hiện các mảng đỏ
 Bầm tím ở vùng da chân sau
Bầm tím ở vùng da chân sau
 Heo con sưng mắt
Heo con sưng mắt
Trên heo con theo mẹ
Giai đoạn mới nhiễm bệnh trong đàn, heo nái chưa có kháng thể chống bệnh, virus xâm nhập bào thai:
+ Heo con mới sinh yếu, run, bú yếu rồi chết.
+ Một số trường hợp mắt heo con sưng phù, bỏ bú, tiêu chảy rồi chết. Những con còn sống thường chậm lớn, một số chết do viêm phổi cấp tính trong giai đoạn sau cai sữa.
Các heo con sinh ra do không bị nhiễm virus giai đoạn bào thai, có kháng thể mẹ truyền nhờ bú sữa đầu nên khoẻ mạnh, nhưng sẽ nhiễm bệnh lúc 6-8 tuần do kháng thể mẹ truyền giảm và mầm bệnh đang lưu hành trong trại.
Trong trại do mức kháng thể một số nái không cao, do đó một số heo con vẫn nhiễm virus lúc mang thai gây sẩy thai trên một số bầy, heo con yếu và chết vẫn cao hơn mức cho phép (trên 10%).
Trên heo con sau cai sữa và heo thịt
- Heo con thường nhiễm virus từ các heo bài trùng và phát bệnh sau 6 – 8 tuần tuổi do kháng thể mẹ truyền giảm.
- Virus tấn công phá vỡ đại thực bào, bạch cầu trong phế nang, tạo điều kiện cho các loại vi khuẩn phát triễn (Pasteurella, Bordetella, Haemophillus, Streptococcus, Actinobacillus) gây viêm phổi cấp.
- Bệnh viêm phổi sẽ trầm trọng hơn nếu không tiêm phòng Mycoplasma.
- Các triệu chứng thường gặp:
+ Sốt cao
+ Ho, thở bụng
+ Bỏ ăn
+ Chảy máu mũi hoặc không
+ Chết sau 1-2 ngày mắc bệnh
+ Các heo chữa khỏi đều chậm lớn
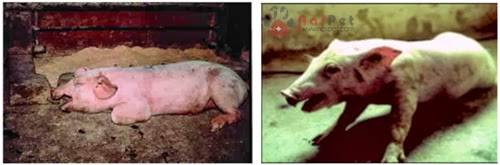 Heo có biểu hiện khó thở
Heo có biểu hiện khó thở
 Heo bệnh lăn ra chết
Heo bệnh lăn ra chết
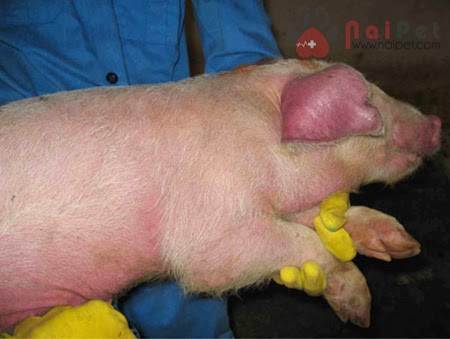 Những con còn sống vẫn tím tái do nhiễm bệnh
Những con còn sống vẫn tím tái do nhiễm bệnh
IV. Bệnh tích
Da tím bầm ở vùng tai, chân, lưng và hông
Phổi viêm, hoại tử và xuất huyết những mãnh to và cứng
 Heo chết có da tím bầm
Heo chết có da tím bầm
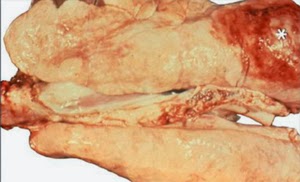 Phổi bị viêm do heo nhiễm PRRS
Phổi bị viêm do heo nhiễm PRRS
 Phổi bị xuất huyết do heo nhiễm PRRS
Phổi bị xuất huyết do heo nhiễm PRRS
V. Phòng bệnh
Thường xuyên vệ sinh tiêu độc chuồng trại và môi trường xung quanh, phun thuốc sát trùng.
Chăm sóc nuôi dưỡng tốt nhằm tăng sức đề kháng cho heo:
- Bổ sung các thuốc trợ lực B-complex, Vitamin ADE, các chất điện giải như Elecholyte, Orezol… vào thức ăn , nước uống thường xuyên.
- Nguồn thức ăn cung cấp cho heo phải đảm bảo đầy đủ dưỡng chất, thức ăn không bị ôi thiu, nhiễm độc tố nấm mốc.
- Trong số những chất dinh dưỡng cho động vật nuôi, nước là chất dinh dưỡng rẻ nhất nhưng lại quan trọng nhất. Do đó cần cung cấp cho heo nguồn nước phải sạch, thường xuyên kiểm tra định kỳ nguồn nước để tránh được tình trạng nhiễm khuẩn.
Có thể dùng một số loại kháng sinh dạng bột định kỳ trộn vào thức ăn 2 lần/tháng, mỗi lần ăn liên tục 3-5 ngày (Tylosin, Colistin, Tetracyclin).
Tiêm vaccine phòng bệnh tai xanh cho tất cả các loại heo, đồng thời tiêm phòng đầy đủ các loại vaccine phòng bệnh Dịch Tả, Tụ Huyết Trùng, Đóng Dấu, Phó Thương Hàn để hạn chế bệnh kế phát. Tuy nhiên vaccine không ngăn ngừa được sự nhiễm bệnh, chỉ giúp giảm mức độ trầm trọng của bệnh. Trại nhiễm bệnh, vaccine có tác dụng giảm tỉ lệ sẩy thai, giảm tỉ lệ heo con chết giai đoạn theo mẹ thông qua việc nâng cao hàm lượng kháng thể trong máu heo nái và kháng thể mẹ truyền cho heo con.
Không nhập heo bị bệnh, heo không rõ nguồn gốc hoặc heo mới nhập về phải nhốt riêng từ 10-15 ngày theo dõi nếu không có dấu hiệu của bệnh mới cho nhập đàn.
VI. Trị bệnh
Khi dịch bệnh xảy ra có rất nhiều việc phải làm, nếu không sắp xếp theo thứ tự thì việc điều trị bệnh không cao, thời gian trị bệnh sẽ kéo dài, chi phí cao… Do đó khi phát hiện trong trại có dấu hiệu của bệnh thì một số công việc chính cần thực hiện theo trình tự như sau:
- Tổ chức vệ sinh tiêu độc chuồng trại, môi trường xung quanh, rắc vôi bột, phun thuốc khử trùng. Việc này giúp giảm mầm bệnh trong chuồng và giảm độc lực của virus gây bệnh hạn chế được sự lây lan từ thú bệnh sang thú khỏe.
- Sát trùng kỹ các xe ra vào trại, đề phòng nhiễm các bệnh kế phát.
- Cần quản lý chặt chẽ công nhân làm việc trong trại, không cho lẫn lộn với công nhân khu vực khác đồng thời phải phun thuốc sát trùng trước khi vào trại.
- Khi dịch bệnh xảy ra, nên sát trùng 2 – 3 lần mỗi tuần bằng các chất sát trùng thông thường nhưng tốt nhất nên sử dụng thuốc sát trùng có tên Vikon cho đến khi trại hết dịch bệnh.
Cải thiện lại môi trường chuồng trại: Chuồng trại phải thông thoáng, ít chất thải, nền chuồng luôn khô ráo…
Bệnh không có thuốc đặc trị nên cần dùng một số loại kháng sinh phòng lây lan và chống sự kế phát của các bệnh khác. Có thể dùng các loại kháng sinh như Tylosin, Tiamulin, hoặc Tetracycline, Colistin… tiêm hoặc trộn vào thức ăn cho đàn heo đang mắc bệnh.
Tuy nhiên hiện nay trên thị trường có một loại thuốc với tên gọi Racxin điều trị các triệu chứng hô hấp do tai xanh gây ra hiệu quả cao nhưng giá rất đắt và không trị được trường hợp sẩy thai ở heo nái mang thai. Do đó người chăn nuôi cần phải cân nhắc trước khi sử dụng loại thuốc này.
————————————————————————————————————————————————————-
Bài 2: Hội Chứng Rối Loạn Hô Hấp Và Sinh Sản Ở Heo PRRS
Tóm tắt:
Hội chứng rối loạn sinh sản và hô hấp trên heo (PRRS) có đặc điểm là thất bại sinh sản ở heo nái và các vần đề hô hấp của heo con và heo cai sữa. Bệnh do virus PRRS, một loại virus hiện nay được xếp vào thành viên của bộ Nidovirales, họ Arteriviridae, giống Artevirus. Tế bào mục tiêu hàng đầu của virus này là đại thực bào trong phế nang của heo. Hiện có hai chủng kháng nguyên chính của virus, là chủng Châu Âu và chủng Châu Mỹ. Virus chủ yếu truyền lây từ heo bị nhiễm bệnh, nhưng virus cũng truyền lây qua phân, nước tiểu, tinh dịch và dụng cụ.
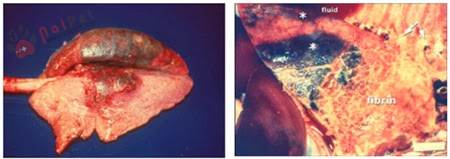
 PRRS trên heo cai sữa.
PRRS trên heo cai sữa.
Hội chứng rối loạn sinh sản và hô hấp xảy ra chủ yếu tại các khu vực có chăn nuôi heo trên thể giới. Rối loạn sinh sản có đặc điểm là vô sinh, chết thai muộn, xảy thai, đẻ non và sinh ra heo con yếu ớt, heo con thường chết sớm sau khi sinh do bệnh đường hô hấp và các bệnh phụ nhiễm. Heo lớn hơn có thể thể hiện các triệu chứng nhẹ của bệnh đường hô hấp, thường phức tạp thêm do phụ nhiễm. Không thấy có loài thú vật nào khác thể hiện bị nhiễm tự nhiên với virus bệnh PRRS.
Nhận diện tác nhân: Các chẩn đoán virus học đối với bệnh nhiễm virus PRRS khá khó khăn; virus này có thể phân lập được từ các mô như huyết thanh, các dịch tiết từ heo còi cọc (ascitic fliuds), phổi, hạch hạnh nhân (tonsil), các hạch bạch huyết và lách của heo bị bệnh. Do các đại thực bào phế nang của heo là hệ thống nuôi cấy mẫn cảm nhất cho virus của cả hai chủng kháng nguyên, những tế bào này được khuyên dùng cho phân lập virus. Các tế bào MARC-145 (dòng vô tính MA-104) cũng thích hợp. Ở đây có khác biệt giữa các lô đại thực bào về khả năng mẫn cảm với virus PRRS. Do đó, cần phải tìm ra các lô đại thực bào có khả năng mẫn cảm cao, và bảo quản lô này trong nitrogen lỏng cho đến khi cần dùng. Virus được nhận diện và phân loại bằng nhuộm màu miễn dịch với kháng huyết thanh đặc hiệu. Các kỹ thuật bổ trợ như miễn dịch mô bào học và lai ghép tại phòng thí nghiệm (in situ) trong các mô đã được cố định và phản ứng chuỗi đa phân tử enzyme giải mã đảo ngược (reverse-transcription polymerase chain reaction) đã được phát triển để xác nhận bệnh nhiễm PRRS tại phòng thí nghiệm.
Các xét nghiệm huyết thanh học: Có nhiều xét nghiệm hiện nay để phát hiện các kháng thể trong huyết thanh đối với virus PRRS. Xét nghiệm miễn dịch ô xy hóa đơn lớp (immunoperoxidase monolayer assay) sử dụng các đại thực bào phế nang và xét nghiệm miễn dịch huỳnh quang gián tiếp sử dụng các tế bào MARC-145 thường được gây nhiễm bằng cả hai chủng kháng nguyên Châu Âu và Châu Mỹ. Tuy nhiên, cả hai xét nghiệm này đều được thiết kế theo cả dạng tế bào lẫn theo virus PRRS. Xét nghiệm thương mại ELISA hiện nay thường được sử dụng. Một bộ xét nghiệm thương mại đặc hiệu cho cả chủng virus Châu Âu lẫn Châu Mỹ. Một bộ xét nghiệm ELISA gián tiếp, là ELISA ghép khối (blocking ELISA) và ELISA kép (double ELISA) có thể phân biệt giữa các phản ứng huyết thanh của chủng Châu Âu với chủng Châu Mỹ.
Các yêu cầu cho vaccin và các chẩn đoán sinh học: Các vaccin có thể có giá trị giúp ngăn ngừa các dạng triệu chứng rối loạn sinh sản và hô hấp của PRRS. Các vaccin có virus sống đã làm biến đổi thì không thích hợp sử dụng cho nái mang thai, nái tơ và heo đực. Tiêm phòng vaccin này có thể dẫn đến thải tiết ra virus vaccin trong tinh dịch. Các virus vaccin đã làm biến đổi có thể tồn tại lâu dài trong heo đã được tiêm phòng, và đã có báo cáo về lây lan virus vaccin sang heo không tiêm phòng và sau đó gây ra bệnh do virus vaccin.
A. MỞ ĐẦU
Hội chứng rối loạn sinh sản và hô hấp (PRRS) có đặc điểm là rối loạn sinh sản trên heo nái và bệnh hô hấp trên heo (2). Bệnh này đầu tiên phát hiện ra vào năm 1987 ở Mỹ, và trong vòng vài năm phát triển thành dịch. PRRS là do virus, virus này lần đầu tiên phát hiện thấy ở Hà Lan (33) và được phân loại là thành viên của bộ Nidovirales, họ Arteriviridae, giống Arterivirus (4). Virus PRRS là loại virus RNA kết sợi đơn chiều dương, đặc tính sinh học của virus này đã được phân loại. Ngay sau khi phát hiện, virus đã được phân loại thành các dòng Bắc Mỹ (North American – NA) và dòng Châu Âu (EU), thể hiện hai chủng di truyền có tính kháng nguyên khác nhau (20, 25, 32). Các điều tra đã chứng minh thêm sự khác biệt giữa virus của hai lục địa. Những khác biệt này hiện nay đã trở nên mờ nhạt do virus PRRS giống NA đã du nhập vào Châu Âu (qua sử dụng vaccin đã biến đổi chế tạo từ một dòng NA) và virus giống EU đã tìm thấy ở Bắc Mỹ. Hầu hết các dòng phân lập từ Nam Mỹ và Châu Á đều giống với NA và hình như những virus này được du nhập qua di chuyển của heo và/hoặc tinh dịch.
Ở đây có sự gia tăng biến thể đối với các dòng của hai kiểu gen này, mà góp phần vào tỷ lệ lỗi cao trong quá trình sao chép của virus PRRS (5) và quá trình tái tổ hợp giữa các dòng (28). Ở đây cũng có các mô tả mới về phương pháp nhuộm màu với chỉ số đa hình thái cao, tạo thêm hiểu biết về sự nổi lên các mầm bệnh mới của heo (26). Tác động của tính đa dạng này trong các chẩn đoán và vaccin còn chưa biết nhiều, nhưng đã đặt ra vấn đề và phải được quan tâm.
Hội chứng sinh sản được ghi nhận là xảy thai muộn và đẻ non hay đẻ muộn mà có thai chết và thai khô, heo con sinh ra chết ngay và heo con sinh ra yếu ớt. Sự gia tăng số lượng trường hợp trong giai đoạn cấp tính của ổ dịch bệnh động vật này thường được báo cáo. Có các báo cáo một cách bất thường về rối loạn sinh sản sớm và rối loạn giữa thai kỳ. Ở heo nọc và heo nái hậu bị, có thể quan sát thấy sốt và biếng ăn tạm thời. Hội chứng hô hấp được ghi nhận là khó thở (thoi thóp), sốt, biếng ăn và lờ đờ. Các heo nhỏ hơn thường bị nhiễm nhiều hơn heo lớn, heo nọc và heo nái (hậu bị) thường bị nhiễm không triệu chứng (subclinical infection). Sự gia tăng phụ nhiễm thường xảy ra và tỷ lệ tử vong có thể cao. Ở heo nọc bị nhiễm PRRS tự nhiên và heo nọc đã được tiêm phòng vaccin virus nhược độc, virus PRRS có thể được thải tiết vào tinh dịch, đã có các báo cáo về các biến đổi hình thái và chức năng của tinh trùng (7). Virus truyền lây chủ yếu từ heo đã bị nhiễm và cũng truyền lây qua phân, nước tiểu và tinh dịch. Virus cũng có thể truyền lây một cách gián tiếp, có thể qua các đường khí dung và qua các trung gian cơ học. Các bệnh tích đại thể và vi thể do bệnh nhiễm virus PRRS đã được mô tả (13). Thông thường, các bệnh tích này nặng nề hơn ở thú non. Các khác biệt về độc lực giữa các dòng phân lập của virus PRRS trong một chủng di truyền (genotypes) và giữa các chủng di truyền được cho là dựa vào các quan sát thực tế và một số nghiên cứu thực nghiệm (13). Tuy nhiên ở đây còn phải thực hiện nhiều nghiên cứu sâu rộng về virus PRRS, ở đây còn nhiều lỗ hổng trong hiểu biết về mối liên quan giữa virus PRRS với các bệnh khác, cũng như hiểu biết về đáp ứng miễn dịch đối với virus PRRS.
B. CÁC KỸ THUẬT CHẨN ĐOÁN
1. Nhận diện tác nhân gây bệnh
Việc nhận diện virus PRRS có thể thực hiện bằng phân lập virus, phát hiện các acid nucleic và phát hiện các proteins của virus. Việc phân lập virus có thể khó khăn do tất cả các dòng phân lập (đặc biệt là các virus dòng Châu Âu) có thể không dễ dàng gây nhiễm vào tế bào nuôi cấy lấy từ lớp thế bào MA-104 của thận khỉ (16). Thú vị là hệ thống tế bào nuôi cấy liên tục này chỉ có một báo cáo về dung nạp gây nhiễm bởi virus PRRS. Các đại thực bào phế nang của heo (porcine alveolar macrophage – PAM) sẽ giúp cho hầu hết các dòng phân lập của virus PRRS (nhưng không phải là tất cả) sinh sôi được. Tuy nhiên, việc thu thập PAM là công việc không dễ dàng do chỉ có heo với tình trạng sức khỏe khỏe mạnh và dưới 8 tuần tuổi mới sử dụng được làm nguồn cung cấp PAM (33). Các lô PAM khác nhau thường không có khả năng mẫn cảm giống nhau đối với virus PRRS; do đó cần phải xét nghiệm từng lô trước khi sử dụng. PAM có thể được dự trữ trong nitrogen lỏng cho đến khi đem sử dụng, như mô tả phần sau. Việc phân lập virus PRRS sử dụng PAM là một kỹ thuật mà có thể thực hiện được trong hầu hết các phòng thí nghiệm chẩn đoán. Kỹ thuật này có độ nhạy để phân lập được tất cả các dòng virus PRRS và sẽ được giải thích chi tiết. Việc phát hiện acid nucleic của virus PRRS có thể thực hiện được bằng phản ứng chuỗi phân tử sử dụng enzyme giải mã nghịch đảo (reverse-transcription polymerase chain reaction – RT-PCR), RT-PCR chồng lớp (nested set RT-PCR) và RT-PCR thời gian thực (real-time RT-PCR) (17, 18, 22, 30, 31). Những xét nghiệm này thường được áp dụng để phát hiện acid nucleic trong các mô và huyết thanh. Các xét nghiệm này cũng có ích khi việc phân lập virus chưa chắc chắn, như khi xét nghiệm tinh dịch (7) và xét nghiệm cho các mô mà đã bị phân hủy phần nào bởi tự dung giải (autolysis) hay bởi nhiệt độ trong quá trình vận chuyển các mẫu đi phân lập virus. Một xét nghiệm PCR phức hợp (multiplex PCR) đã được thiết kế để phân biệt các dòng phân lập Bắc Mỹ với Châu Âu (11). Các phân tích độ dài đoạn đa hình thái của các sản phẩm PCR-khuyếch đại đã được phát triển để phân biệt các dòng virus thực địa với virus vaccin (34) và mới đây, các nghiên cứu dịch tễ học phân tử về các dòng virus PRRS đã được thực hiện, sử dụng các phân tích phân loài học trong các cấu trúc kết nối gen di truyền đặc hiệu. Tất cả các xét nghiệm về acis nucleic này thường nhanh chóng hơn so với phân lập virus và không cần đến cơ sở tế bào nuôi cấy. Mặc dù hiếm khi áp dụng cho các mục đích chẩn đoán, việc lai ghép trong phòng thí nghiệm (in situ) là khả năng cho phát hiện và phân biệt giữa các kiểu di truyền của virus PRRS Bắc Mỹ với Châu Âu trong các mô đã được cố định bằng formalin (20). Hóa miễn dịch mô bào (immunohistochemistry) có thể áp dụng được để phát hiện các proteins của virus (12, 19) và khi thực hiện trên các mô đã được cố định bằng formalin cho phép hiển thị được kháng nguyên cùng với các bệnh tích mô bào học.
a) Thu thập các đại thực bào phế nang từ phổi
Thích hợp là phổi lấy từ heo SPF hay từ đàn heo mà chứng minh được là sạch đối với bệnh nhiễm virus PRRS. Các kết quả tốt nhất thu được từ các heo dưới 8 tuần tuổi. Các đại thực bào phải được thu thập từ phổi trong ngày mà heo được giết mổ. Phổi được rửa ba hay bốn lần với tổng thể tích nước muối đệm phosphate (phosphate buffered saline – PBS). Dịch rửa thu gom được sau đó được ly tâm trong 10 phút ở 1000 g. Các đại thực bào trầm lắng thu được sau đó được tái hòa tan trong PBS và ly tâm (thao tác rửa) hai lần nữa. Trầm lắng cuối cùng được hòa tan trong 50 ml PBS, và số lượng các đại thực bào được đếm để tính toán hàm lượng. Các đại thực bào này sau đó có thể được sử dụng tươi, hay có thể được bảo quản trong nitrogen lỏng theo các phương pháp chuẩn ở hàm lượng cuối cùng khoảng 4 x 107 đại thực bào/1,5 ml. Các lô đại thực bào không nên đem trộn chung.
b) Xét nghiệm theo lô các đại thực bào phế nang
Trước khi một lô đại thực bào có thể sử dụng được, thì phải được đánh giá. Điều này sẽ thực hiện bằng cách chuẩn độ một lượng virus PRRS đã biết trước chuẩn độ vào các đại thực bào mới, và bằng thực hiện một xét nghiệm đơn lớp miễn dịch ô xy hóa (immunoperoxidase monolayer assay – IPMA) với huyết thanh biết trước là dương tính và âm tính trên các phiến cấy với các đại thực bào mới. Các tế bào này chỉ thích hợp cho sử dụng nếu virus PRRS chuẩn phát triển đến hiệu giá đã được chỉ định, (TCID50 hay 50% liều lượng gây nhiễm mô cấy – Tissue Culture Infective Dose). Ở đây khuyến cáo là các đại thực bào phế nang và huyết thanh phôi bò (Fetal Bovine Serum – FBS) dùng cho môi trường nuôi cấy phải sạch đối với pestivirus.
c) Phân lập virus trên các đại thực bào phế nang
Các đại thực bào phế nang được cấy vào các giếng đáy bằng của các phiến vi hiệu giá tăng dần dùng cấy mô. Sau khi cấy, các đại thực bào được gây nhiễm bằng mẫu xét nghiệm. Các mẫu xét nghiệm có thể là huyết thanh hay dịch cơ thể, hay nhuyễn dịch của các mô, như hạch hạnh nhân, phổi, các hạch bạch huyết và lách. Thông thường, virus PRRS gây ra tác động bệnh tích tế bào (cytopathic effect – CPE) trong các đại thực bào, sau 1-2 ngày cấy, nhưng đôi khi virus cho thấy có ít CPE hay chỉ gây CPE sau khi cấy truyền lặp lại. Sau thời gian 1-2 ngày hoặc chỉ khi phát hiện thấy CPE, thì sự hiện diện của virus PRRS cần được xác nhận bằng nhuộm màu miễn dịch (immunostaining) với một kháng huyết thanh đặc hiệu hay một kháng thể đơn giá (monoclonal antibody – MAb).
i) Cấy các đại thực bào vào các phiến vi hiệu giá (microtitre plates)
Làm tan giá một chai chứa 6 x 107 đại thực bào/1,5 ml. Rửa các tế bào một lần với 50 ml PBS và ly tâm dung dịch chứa tế bào này trong 10 phút ở 300 g (nhiệt độ phòng). Thu thập các tế bào này trong 40 ml môi trường 1640 RPMI (Rose-Peake Memorial Institute) được bổ sung 5% FBS và 10% hỗn hợp kháng sinh (môi trường phát triển). Chia 100 µl dịch chứa tế bào vào từng giếng của phiến vi hiệu giá (với một chai chứa tế bào có thể cấy vào bốn phiến ở hàm lượng 105 tế bào trong mỗi giếng của các phiến).
ii) Sửa soạn mẫu (huyết thanh, dịch cơ thể, nhuyển dịch mô 10%) pha loãng trong một phiến đệm (dummy plate)
Chia 90 µl môi trường nuôi cấy vào từng giếng của phiến vi hiệu giá. Thêm 10 µl vào các giếng của các hàng A và E ( độ pha loãng giống nhau 1/10). Lắc các phiến và chuyển 10 µl từ các hàng A và E sang các hàng B và F (độ pha loãng 1/100). Lắc các phiến và chuyển 10 µl từ các hàng B và F sang các hàng C và G (độ pha loãng 1/1000). Lắc các phiến và chuyển 10 µl từ các hàng C và G sang các hàng D và H (độ pha loãng 1/10.000). Lắc các phiến.
iii) Ủ cấy (incubation) các mẫu
Chuyển 50 µl của các độ pha loãng từ phiến pha loãng này đến các giếng tương ứng của phiến có các đại thực bào (cấy truyền lần đầu). Ủ cấy trong 2-5 ngày và quan sát hàng ngày về CPE. Ở ngày thứ 2, cấy các đại thực bào trong một phiến vi hiệu giá mới (xem phần trên). Truyền 25 µl phù nổi từ phiến cấy truyền lần đầu vào các giếng tương ứng của phiến nuôi cấy mới (cấy truyền lần hai). Ủ cấy trong 2-5 ngày và hàng ngày quan sát CPE.
iv) Đọc và giải thích các kết quả
Khi các đại thực bào chỉ thể hiện CPE trên cấy truyền lần đầu thì được coi là dương tính sai do độc tính của mẫu. Khi các đại thực bào của cả hai lần cấy truyền đều thể hiện CPE hay chỉ thể hiện CPE trên lần cấy truyền thứ nhì thì được coi là nghi ngờ dương tính. Khi tất cả các đại thực bào đơn lớp mà không thể hiện CPE, cần phải được xác định là âm tính với virus PRRS bằng nhuộm miễn dịch với một kháng huyết thanh dương tính với virus PRRS hay bằng MAb. Các mẫu có CPE dương tính cần phải được xác định là dương tính với virus PRRS bằng nuôi cấy các phù nổi có CPE dương tính, hay bằng dung dịch mẫu nguyên gốc, trong cả 24 lẫn 48 giờ trong các đại thực bào, sau đó bằng nhuộm miễn dịch với một kháng huyết thanh dương tính với virus PRRS hay MAb.
v) Nhuộm màu miễn dịch (immunostaining) bằng kháng huyết thanh dương tính đối với virus PRRS hay bằng kháng thể đơn giá (MAb). Gây nhiễm các đại thực bào bằng 50 µl phù nổi hay mẫu mô như được mô tả trong Đoạn B.2.a, và nuôi các tế bào đã gây nhiễm trong 24 và 48 giờ. Sửa soạn một độ pha loãng thích hợp của một huyết thanh dương tính với virus PRRS trong dung dịch đệm pha loãng, và nhuộm màu các đại thực bào như mô tả trong Đoạn B.2.a hay B.2.b.
Naipet.com